CytExpert工具21 CFR第11部分符合性
所有存储用于作出质量决策的数据或将报告给FDA的数据的计算机系统必须符合21 CFR Part 11的。该法的目的是确定在其下电子记录和电子签名被认为是可信的,可靠的,并且等同于纸质记录的标准。
21 CFR Part 11引用联邦法规法典(CFR)中列出美国食品和药物管理局(FDA)关于使用电子记录和电子签名的指南的章节。该法规适用于一系列受监管行业,包括制药、生物制品、医疗器械和食品(人类和兽医)。在美国开展业务的这些部门的公司,向制药公司提供原材料和组件的供应商,以及委托进行分析的合同实验室,都必须确保电子记录和电子签名是值得信赖的和可靠的。
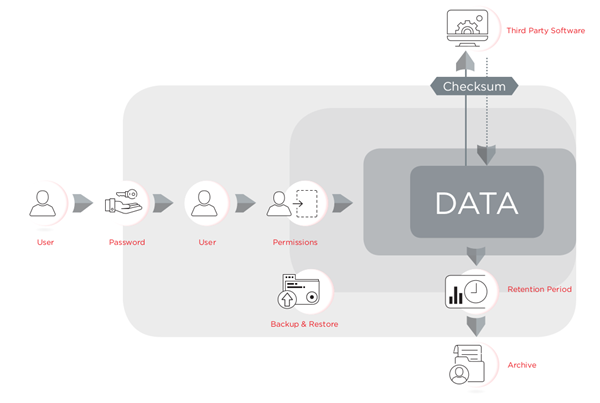
该法规要求组织已经制定三级控制:如标准操作程序使用本系统和技术控制的内置软件的功能,以确保电子的可靠性和完整性,如对电子记录,程序控制策略的管理控制记录和签名。软件可以被设计成便于符合21所CFR Part 11所的技术控制,但实验室人员负责提供政策和程序,并确保其正确使用,并确保其过程符合规定。包括在CytExpert V2.3或更高的电子文件管理工具,可用于CytoFLEX流式细胞仪平台,旨在促进符合21 CFR第11部分。CytExpert为CytoFLEX是一个有密码保护软件,使用控制仪器的运行,保障数据完整性校验的控制和审计跟踪,并提供文件控制使用签名,签名等级和归档。